Tabla periódica.
En 1913, el físico inglés Henry Moseley ordenó los elementos de acuerdo con su número atómico (Z), que es igual al número de protones que hay en el núcleo de un átomo. Moseley descubrió que cada elemento tiene una única carga nuclear y, además, un número atómico diferente.
La tabla periódica de los elementos clasifica, organiza y distribuye los distintos elementos químicos, conforme a sus propiedades y características; su función principal es establecer un orden específico agrupando elementos.
En la tabla periódica moderna, los elementos se colocan en orden creciente de número atómico y no por el de masa atómica. Está constituida por dieciocho grupos o familias químicas y siete periodos.
Grupos
A las columnas verticales de la tabla periódica se les conoce como grupos. Todos los elementos que pertenecen a un grupo tienen la misma valencia atómica, y por ello, tienen características o propiedades similares entre sí.
Existen en la tabla actual 18 grupos o familias, que la IUPAC ( International Union of Pure and Applied Chemistry ) recomienda hoy numerar del 1 al 18. Así, los elementos del grupo 1 poseen un electrón de valencia, los del grupo 2, tienen dos, y así hasta los del grupo 10 que poseen 10 electrones de valencia. Del grupo 11 al 18, los electrones de valencia son los que quedan al restar 10 al número del grupo. Los del grupo 15, por ejemplo tienen 5 electrones de valencia, los del 16 tienen 6 hasta llegar al grupo 18 cuyo elementos poseen 8 electrones de valencia, a excepción del helio que tiene 2.
Numerados de izquierda a derecha utilizando números arábigos, según la última recomendación de la IUPAC de 1988, los grupos de la tabla periódica son:
Grupo 1 (I A): los metales alcalinos. Grupo 2 (II A): los metales alcalinotérreos. Grupo 3 (III B): Familia del Escandio. Grupo 4 (IV B): Familia del Titanio. Grupo 5 (V B): Familia del Vanadio. Grupo 6 (VI B): Familia del Cromo. Grupo 7 (VII B): Familia del Manganeso. Grupo 8 (VIII B): Familia del Hierro. Grupo 9 (IX B): Familia del Cobalto. Grupo 10 (X B): Familia del Níquel. Grupo 11 (I B): Familia del Cobre. Grupo 12 (II B): Familia del Zinc. Grupo 13 (III A): los térreos. Grupo 14 (IV A): los carbonoideos. Grupo 15 (V A): los nitrogenoideos. Grupo 16 (VI A): los calcógenos o anfígenos. Grupo 17 (VII A): los halógenos. Grupo 18 (VIII A): los gases nobles.
Períodos
La tabla periódica consta de 7 períodos y corresponden a las filas horizontales de la tabla periódica. Los elementos de un mismo período tienen igual número de niveles de energía (n). Contrario a como ocurre en el caso de los grupos de la tabla periódica, los elementos que componen una misma fila tienen propiedades diferentes pero masas similares: todos los elementos de un período tienen el mismo número de orbitales. Siguiendo esa norma, cada elemento se coloca según su configuración electrónica. El primer período solo tiene dos miembros: hidrógeno y helio; ambos tienen sólo el orbital 1s.
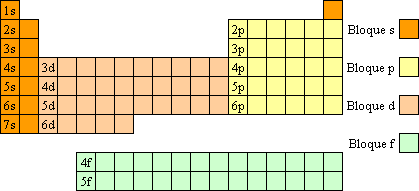
Bloques o regiones
La tabla periódica se puede también dividir en cuatro bloques de elementos (s, p, d, f) según el orbital que estén ocupando los electrones más externos.
Los bloques o regiones se denominan según la letra que hace referencia al orbital más externo: s, p, d y f. Podría haber más elementos que llenarían otros orbitales, pero no se han sintetizado o descubierto; en este caso se continúa con el orden alfabético para nombrarlos.
Los bloques están ubicados en el orden sdp, de izquierda a derecha, y f lantánidos y actínidos.
Al hidrógeno no se lo ha encontrado una ubicación satisfactoria, pues por su estructura electrónica le corresponde el grupo 1, pero sus propiedades se asemejan más al grupo 17.
Los bloques s y p corresponden a los elementos representativos y, entre ellos, encontramos tanto metales como no metales. Los elementos del bloque d se denominan elementos de transición y son todos metálicos. El bloque f está integrado por los elementos de transición interna, que son también metales, la mayoría obtenidos en el laboratorio; son radiactivos o de vida media muy corta.
Comentarios
Publicar un comentario